أهلا وسهلا بك إلى ملتقى الفيزيائيين العرب.
أهلا وسهلا بك زائرنا الكريم، إذا كانت هذه زيارتك الأولى للمنتدى، فيرجى التكرم بزيارة صفحة التعليمـــات، بالضغط هنا.
كما يشرفنا أن تقوم بالتسجيل بالضغط هنا إذا رغبت بالمشاركة في المنتدى، أما إذا رغبت بقراءة المواضيع والإطلاع فتفضل بزيارة القسم الذي ترغب أدناه.
| ملتقى الفيزيائيين العرب > قسم المناهج الدراسية > فيزياء المرحلة الثانوية. > الصف الثالث الثانوي | ||
| الدُرر البهيّة في شرح الديناميكا الحراريّة - مع مناقشة شاملة للفصل الثالث ( 3ث - ف1 ) | ||
| الملاحظات |
|
|
أدوات الموضوع | انواع عرض الموضوع |
|
|
|
#1
|
|||
|
|||
|
بسم الله الرحمن الرحيم
الحمد لله وكفى والصلاة والسلام على النبي المصطفى وعلى آله وصحبه ومن أقتفى ، وبعد [align=center]  [/align] [/align]أخوتـــي الكــــرام .. الســــلام عليكـــم ورحمـــة الله وبركاتـــه يسعدني أن أقدم لكم شرحا للفصل الثالث : الديناميكا الحرارية مقسما إلى محاضرات مقرونا بوسائل محاكاة مفيدة جــدا فــي التوضيح ، وأســأل الله عز وجــل أن ينفــع بـــهذا الشــــــرح والمناقشات حوله راجيا منكم الدعــاء لي ولوالــدي ولأهــلي وأحب أن أنوه قبل البدء بالشــرح إلى التنظيمــات التــاليـــة :
أخوكم  |
|
#2
|
|||
|
|||
|
[align=justify]
المحاضرة الأول : الديناميكا الحرارية Thermodynamics مقدمة : [align=justify]الديناميكا الحرارية هي فرع من فروع الفيزياء القديمة تبحث عن العلاقة بين الحرارة والشغل ، وتحويل إحداهما إلى الأخرى ، كما تبحث عن كيفية إنتاج الحرارة وانتقالها من موقع إلى آخر وتأثيرها على المادة وكيفية تخزينها . ولا تقدم الديناميكا الحرارية أي فرضية بخصوص الطبيعة الجزيئية أو الذرية للمادة وإنما هي علم تجريبي أو شبه تجريبي فجميع قوانينه وأساسياته مستخلصة من التجارب والمشاهدات . ورغم أن الديناميكا الحرارية تستطيع الربط بين كثير من الكميات المقيسة أو التي تقع تحت الحس المباشر ، إلا أنها لا تستطيع إعطاء قيم مطلقة لتلك الكميات . وإذا ما أريد دراسة المواد بعمق أكثر لزم الربط بين الديناميكا الحرارية والنظرية الجزيئية أو الذرية للمواد . وينتج من هذا التزاوج بين هذين الموضوعين ما يعرف بالميكانيكا الإحصائية أو الفيزياء الإحصائية . هناك نقطة أخرى وهي أن مبادئ الديناميكا الحرارية قد تدلنا على اتجاه التفاعل الذي يجري في النظام ( سيأتي تعريف لهذا المصطلح ) فمثلاً هل ستزداد درجة حرارة النظام أم ستنقص أو هل سيتحول النظام من طور غازي إلى سائل أو إلى جامد أو العكس ، ولكنها لا تستطيع أن تدلنا على سرعة هذا التفاعل أو معدل حدوثه مع الزمن ، وإذا ما أريد معرفة ذلك لزم أن تؤخذ الطبيعة الجزيئية أو الذرية وحركية تلك الجسيمات بعين الاعتبار . وبالتالي فإن الديناميكا الحرارية تمكننا من أن نتوقع إمكانية حدوث التفاعل الكيميائي تلقائياً تحت ظروف معينة، وبذلك فإنه يمكننا توفير كثير من الجهد والوقت والمال ببعض حسابات الديناميكا الحرارية. يبنى علم الديناميكا الحرارية على قانونين أساسيين من قوانين الفيزياء هما القانون الأول والقانون الثاني في الديناميكا الحرارية . وعبر هذين القانونين العامين يمكن الربط بين كثير من خواص المادة . من المفيد ذكره أن الديناميكا الحرارية تشمل أيضاً علم التقريس الذي يدرس المواد عند درجات منخفضة جداً من الحرارة ، كما أن مبادئ الديناميكا الحرارية ضرورية لفهم كل أنواع الآلات الحرارية التي تشمل آلات الديزل والبنزين والبخار كما تشمل آلات أجهزة التبريد. مصطلحات الديناميكا الحرارية : كل علم من العلوم وكل تخصص من التخصصات له مفاهيمه الأساسية التي تعتبر بمثابة اللغة التي نستخدمها لشرح مواضيع هذا العلم أو هذا التخصص ، ومن هذه المصطلحات التي ستتكرر مع دراستنا للديناميكا الحرارية ما يلي : النظام system : يقصد به جزء محدد من المادة له حدود معينة سواء كانت حقيقة أم وهمية ينصب الاهتمام عليه . وبمعنى آخر : كمية محدود وموصوفة من مادة تكون محاطة بغلاف أو حدود حقيقي أو تخيلي ، يمكن أن يكون ثابتا أو متحركا . ويلعب النظام دورا أساسيا في دراسة العلاقة بين الطاقة الميكانيكية والطاقة الحرارية .  محيط النظام surrounding : الوسط المحيط بالنظام من فراغ أو مادة سواء تفاعل مع النظام أم لم يتفاعل . 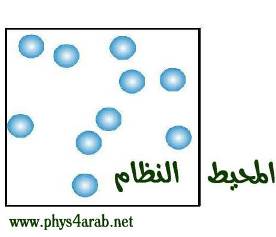 أمثلة على الأنظمة الحرارية : 1 – غاز محصور في أسطوانة 2 – غاز في وعاء 3 – جزيئات ما في محلول 4 – شريط مطاطي ( نظام معقدّ ) 5 – نظام التدفئة المركزية 6 – نظام التبريد في الآلات والمحركات 7 – الآلات البخارية  أنواع الأنظمة : النظام المفتوح open system: هو الذي تسمح حدوده بتبادل الحرارة والمادة مع محيط النظام .   النظام المغلق closed system: وهو الذي لا تسمح حدوده بتبادل المادة مع محيط النظام ولكن تسمح بتبادل الشغل والحرارة .   النظام المعزول isolated system: هو الذي لا تسمح حدوده بتبادل المادة والحرارة والشغل مع محيط النظام .[/align]   مقارنة :  |
|
#3
|
|||
|
|||
|
المحاضرة الثانية : ( تابع - مصطلحات الديناميكا الحرارية ) وصف النظام Description of the system: [align=justify]للتعرف على النظام يلزم إعطاء وصف دقيق لها ، وهناك طريقتان لوصف النظام هما : الطريقة المجهرية (الميكروسكوبية ) microscopic تُعنى بدراسة التفاصيل الكاملة لحركة الذرات أو الجزيئات في النظام والعلاقة بينها ، ولكي نعطي وصفاً كاملاً يلزم تحديد موقع وسرعة كل جسيم . ففي الإحداثيات الكارتزية مثلاً يلزم تحديد x , y , z لكل جسيم وكذلك معرفة Vx ، Vy ، Vz لكل جسيم ، وحيث أن الجسيمات تكون في حالة حركة دائبة فهذا الوصف إنما يصف حالة المادة في لحظة من اللحظات فقط ، وفي لحظة تالية يلزم إعطاء وصف جديد وهكذا . وهذا هو ميدان الميكانيكا الإحصائية . الطريقة الجهرية ( الماكروسكوبية ) macroscopic تُعنى بدراسة العلاقة بين متغيرات النظام مثل : الكتلة والضغط والحجم ودرجة الحرارة ( يمكن قياسها ) والطاقة الداخلية والشغل ( يمكن حسابهما ) وهذا هو ميدان الديناميكا الحرارية . الفلاشات التالية ، تدرس العلاقة بين متغيرات النظام الجهرية : [FLASH="http://www.phys4arab.net/vb/images/sharh/de40.swf"]width=400 height=350[/FLASH] لحفظ الفلاش أضغط هنا بزر الفارة الأيمن ثم حفظ بأسم [FLASH="http://www.phys4arab.net/vb/images/sharh/de41.swf"]width=400 height=350[/FLASH] لحفظ الفلاش أضغط هنا بزر الفارة الأيمن ثم حفظ بأسم الاتزان الحراري thermodynamic equilibrium : هي الحالة التي ينعدم عندها انتقال الحرارة بين الأجسام المتلامسة نتيجة تساوي درجة حرارتهما . العملية ( الإجراء ) process a : تغير في حالة النظام من حالة إلى أخرى بسبب إضافة حرارة أو شغل . المسار The path of a process : عبارة عن الحالات التي تمر بها الخواص النظام مثل ( الضغط – الحجم – درجة الحرارة ) . الدورة الديناميكية الحرارية : يتم النظام دورة إذا مر بعدة إجراءات ( تحولات ) بحيث تتطابق بداية ونهاية الإجراءات . الإجراء العكوس واللاعكوس : هو الإجراء الذي يمكن عكس اتجاهه بعد حدوثه دون التسبب في إحداث أي تغيير في النظام أو المحيط . الطاقة الداخلية internal energy هي الطاقة الكلية للجزيئات ( طاقتها الحركية وطاقتها الكامنة ) فكما نعلم أن جزيئات المادة في حالة حركة مستمرة ، وتمتلك طاقة حركية بسبب هذه الحركة ، كما أنها تختزن طاقة كامنة بسبب القوى المتبادلة بينها . ويمكن زيادة الطاقة الداخلية للنظام بطريقتين : ( 1 ) تزويد النظام بطاقة حرارية من مصدر حراري ( 2 ) بذل شغل على النظام . أما إذا النظام كمية من الحرارة أو بذل النظام نفسه شغلا فإن طاقته الداخلية تقل . المقصود بالشغل work: ليكن لدينا نظام عبارة عن اسطوانة بها غاز محصور مزودة بمكبس خفيف قابل للحركة إلى أعلى وإلى أسفل بسهولة ، عندما نزود النظام ببطء كمية من الحرارة ، فإن الغاز سيتمدد ببطء شديد ، نقول عندها أن النظام بذل شغلا ، وبالمثل عندما نضغط على المكبس ببطء فإننا نقول أنه تم بذل شغل على النظام .  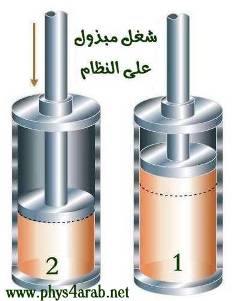 إيجاد الشغل حسابيا : نعلم مما سبق دراسته في الميكانيكا التقليدية أن : شغ = ق × ∆ ف ( والقوة هي حاصل ضرب الضغط في المساحة ) إذا : شغ = ض × س × ∆ ف شغ = ض × ∆ ح إيجاد الشغل بيانيا : يمكن إيجاد الشغل بيانيا من خلال رسم العلاقة بين الحجم والضغط ، ويكون الشغل هو المساحة تحت المنحنى .[/align] 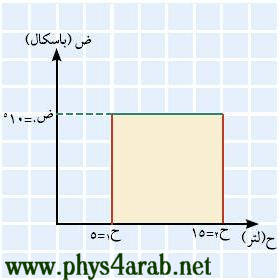 |
|
#4
|
|||
|
|||
|
المحاضرة الثالثة : بعض العمليات ( الإجراءات ) الديناميكية الحرارية : [align=justify]مر علينا المقصود بمصطلح العملية ( الإجراء ) وهي للتذكير: تغير في حالة النظام من حالة إلى أخرى بسبب إضافة حرارة أو شغل . وسنتعرف في هذا الدرس على بعض العمليات الديناميكية الحرارية التي يمكن يمر بها النظام : 1- العملية الأيزوبارية Isobaric process : هي العمليات التي تتم تحت ضغط ثابت ، ويحدث ذلك عندما نزود النظام بكمية من الحرارة ببطء ( أو يفقد ببطء ) ، فينتج عن ذلك زيادة الحجم ( ارتفاع المكبس ) ، ولأن التغير في الحجم كان بطيئا فإن هناك اتزانا ميكانيكيا وعليه فإن الضغط سيبقى ثابتا . ومن الأمثلة على هذه العملية ما يتم في الآلة البخارية .( سيأتي شرحها لاحقا ) 2- العملية الأيزوكورية Isochoric process أو isovolumetric process : هي العمليات التي تتم تحت حجم ثابت ، ويحدث ذلك عندما يكون النظام غير قابل للتمدد ( أي لا يوجد به مكبس خفيف قابل للحركة ) ويزود هذا النظام بكمية من الحرارة ( التسخين مثلا ) ، فينتج عن هذا زيادة في الضغط ، ومن الأمثلة على هذه العملية ما يتم في الاشتعال والانفجار المفاجئ في آلات الاحتراق الداخلي مثل محرك السيارة . 3- العملية الأيزوثيرمية Isothermal process : هي العمليات التي تتم تحت درجة حرارة ثابتة ثابتة ، ويحدث ذلك عندما نسمح بتمدد النظام مع بقاء درجة الحرارة ثابتة ( يقل الضغط تبعا لذلك ) أو بتقلص النظام ( يزداد الضغط تبعا لذلك ). 4- العملية الكظمية Adiabatic process : هي العمليات التي تتم في النظام المعزول حراريا عن الوسط المحيط به ، حيث يكون الغاز محصورا في أسطوانة معزولة حراريا ، ومزودة بمكبس حر الحركة . الفلاشات التالية لمشاهدة هذه الإجراءات : [FLASH="http://www.phys4arab.net/vb/images/sharh/de11.swf"]width=400 height=350[/FLASH] لحفظ الفلاش أضغط هنا بزر الفارة الأيمن ثم حفظ بأسم [FLASH="http://www.phys4arab.net/vb/images/sharh/de12.swf"]width=400 height=350[/FLASH] لحفظ الفلاش أضغط هنا بزر الفارة الأيمن ثم حفظ بأسم [FLASH="http://www.phys4arab.net/vb/images/sharh/de13.swf"]width=400 height=350[/FLASH] لحفظ الفلاش أضغط بزر الفارة الأيمن ثم حفظ بأسم [FLASH="http://www.phys4arab.net/vb/images/sharh/de14.swf"]width=400 height=350[/FLASH] لحفظ الفلاش أضغط بزر الفارة الأيمن ثم حفظ بأسم إيجاد الشغل المبذول في بعض العمليات ( الإجراءات ) الديناميكية الحرارية : للتذكير فإنه يمكن إيجاد الشغل بيانيا من خلال رسم العلاقة بين الحجم والضغط ، ويكون الشغل هو المساحة تحت المنحنى . 1 - إيجاد الشغل بيانيا في العملية الأيزوبارية : بما أن الضغط ثابت مع تغير في الحجم ، فإن المنحنى سيكون مستقيما أفقيا موازيا لمحور الحجم ( السيني ) ، ومن الشكل نستطيع القول بأن الشغل يساوي المساحة تحت المنحنى . شغ = المساحة تحت المنحنى شغ = ض × ∆ ح = ض × ( ح2-ح1) 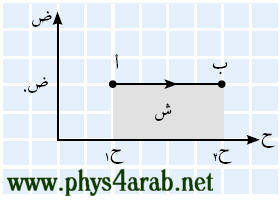 2 - إيجاد الشغل بيانيا في العملية الأيزوكورية : بما أن الحجم ثابت ∆ ح = 0 مع تغير في الضغط ، فإن المنحنى سيكون خطا عموديا موازيا لمحور الضغط ( الصادي ) ومن الرسم يتضح لنا أن : شغ = صفر ( لا توجد مساحة تحت المنحنى ) 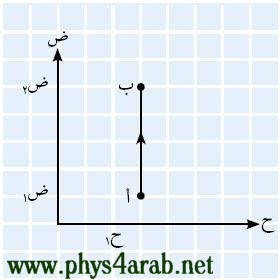 3 - إيجاد الشغل بيانيا في العملية الأيزوثيرمية : بما أنه عند ثبوت درجة الحرارة تكون العلاقة بين الضغط والحجم عكسية ، وبالتالي فإن المنحنى سيكون ذا ميل سالب . ويعطى الشغل بالعلاقة التالية : شغ = ح1 ض1 لو ( ح2/ح1 ) شغ = ح1 ض1 لو ( ض1/ض2 ) 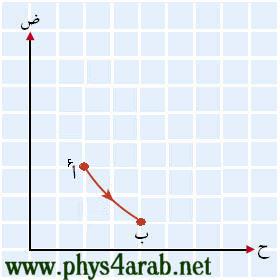 4 - إيجاد الشغل بيانيا في العملية الكظمية : بما أنه لا يوجد تبادل في الحرارة بين الغاز والوسط المحيط به حيث تتم هذه لعملية بسرعة كبيرة نسبيا ، فيكون الشغل مساويا للتغير في الطاقة الداخلية . [/align] |
|
#5
|
|||
|
|||
|
المحاضرة الرابعة : القانون الأول للديناميكا الحرارية : تمهيد : [align=justify]لنفترض أن لدينا نظاما ديناميكيا حراريا يتكون من غاز محصور في أسطوانة مزودة بمكبس ، فإذا سخنا هذا النظام ( أعطيناه حرارة ) فإننا نلاحظ : ( 1 ) ارتفاع درجة حرارة الغاز ، أي أن الطاقة الداخلية للنظام زادت . ( 2 ) تمدد الغاز و ارتفاع المكبس للأعلى ، أي أن النظام قد بذل شغلا . وبحسب قانون حفظ الطاقة فإن كمية الحرارة التي أمتصها النظام تساوي التغير في طاقته الداخلية مضافا إليه الشغل الذي بذله النظام ( هذه النتيجة هي قانون الديناميكا الحرارية الأول ) نص القانون : إن كمية الحرارة التي يمتصها النظام ( أو يفقدها ) تساوي مجموع التغير في طاقته الداخلية والشغل الذي يبذله ( أو يبذل عليه ) . الصيغة الرياضية للقانون : ∆ ط د = كح – شغ جدول الإشارات : 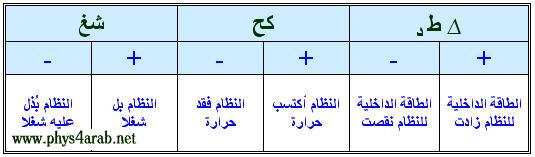 ملاحظات من القانون الأول : ( 1 ) لا يميز القانون الأول بين الشغل والحرارة ، حيث يمكن زيادة الطاقة الداخلية للنظام بتزويده بالحرارة أو ببذل شغل عليه ، أو بكليهما ، وبالتالي تعامل الحرارة في الديناميكا الحرارية كأنها شغل ، فهي طاقة يمكن أن تنتقل عبر الحدود الفاصلة بين النظام والوسط المحيط به ، لكنها تختلف عن الشغل من حيث أن انتقالها مرهون بوجود فرق في درجة الحرارة بين النظام والوسط المحيط ، وتلامسهما أيضا هو شرط آخر لانتقال الحرارة بالتوصيل . ( 2 ) تزويد النظام بالحرارة لا يؤدي إلى تخزينها على شكل حرارة ، بل إلى تخزينها على شكل طاقة حركية ، وطاقة وضع للجزيئات الميكروسكوبية التي يتكون منها هذا النظام ، كما تؤدي إلى زيادة الطاقة الداخلية للنظام . ( 3 ) القانون الأول في الديناميكا الحرارية هو قانون حفظ للطاقة ، فأي زيادة في أي شكل من أشكال الطاقة يصاحبه نقص في شكل آخر . تعليق د. مازن العبادلة : كمية الحرارة التي يكتسبها النظام هي في النهاية طاقة يستفيد منها الجسم على احد منحيين ... الاول انه يبذل شغلا ... والثاني انه يضيفها إلى طاقته الداخلية ... طبعا او هما معا وهو القانون الاول ...وهذايشبه ان تتلقى دعما ما كألف دينار مثلا ...فإما أنك تنفقها او تعمل بها مشروعا (شغل) او انك تضيفها كلها إلى رصيدك في البنك (طاقة داخلية ) او انك قد تتصرف بحكمة فتصرف جزءا وتضع آخر في البنك ...ههه والان كما قالت ربانة تماما... هناك فرق بين الاكتساب والفقد والشغل بواسطة النظام أو على النظام ... فالإيجاب دائما موجب والسلب دائما سالب ...ههه ... يعني من قدم شغلا فهو إيجابي في الحياة حتى ولو خسر شيئا من ممتلكاته ... والذي يستقبل تفضل الناس (شغلهم عليه) هو سلبي يعيش على الاخرين ... هكذا في الدنيا والاجتماعيات ... تطبيق القانون الأول على بعض العمليات ( الإجراءات ) الديناميكية الحرارية 1- العملية الأيزوبارية : نعلم مما سبق أن ، شغ = ض × ( ح2-ح1) إذايصبح القانون الأول ∆ ط د = كح – ض × ( ح2-ح1) 2- العملية الأيزوكورية : نعلم مما سبق أن ، شغ = صفر إذايصبح القانون الأول ∆ ط د = كح 3- العملية الأيزوثيرمية : نعلم مما سبق أن ، شغ = ح1 ض1 لو ( ح2/ح1 ) وأيضا : شغ = ح1 ض1 لو ( ض1/ض2 ) وبما أن درجة الحرارة ثابتة فإن ∆ ط د = صفر إذا: كح = ح1 ض1 لو ( ح2/ح1 ) أو: كح = ح1 ض1 لو ( ض1/ض2 ) 4- العملية الكظمية : بما أن النظام معزول حراريا فإن كح = صفر إذا ∆ ط د = - شغ أي أن الطاقة الداخلية تزداد بمقدار الشغل المبذول[/align] |
|
#6
|
|||
|
|||
|
المحاضرة الخامسة : الآلة الحرارية [align=justify]هي آلة تعمل على تحويل الطاقة الحرارية إلى أشكال أخرى للطاقة مثل الطاقة الميكانيكية أو الطاقة الكهربائية . مراحل دورة الآلة الحرارية : 1 – أخذ طاقة حرارية ( كح2 ) من مستودع حراري ذي درجة حرارة عالية ( د2 ) ( المستودع الساخن : سمي بذلك لأنه يفترض أن تكون درجة حرارته ثابتة ) 2 – تحول الآلة جزءا من هذه الحرارة إلى شغل ميكانيكي ( الآلة تبذل شغلا ) 3 – تزويد الآلة الحرارية بطاقة حرارية ( كح1 ) ذي درجة حرارة منخفضة ( د1 ) إلى المستودع البارد . 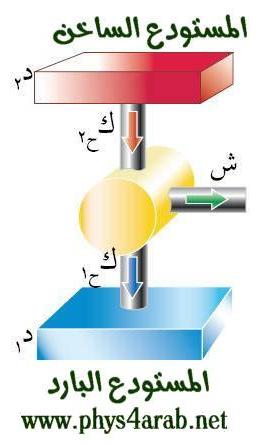 وعند تطبيق القانون الأول في الديناميكا الحرارية : ∆ ط د = كح – شغ ∆ ط د = كح2 – كح1 – شغ ولأن المراحل السابقة هي دورة كاملة ، وبالتالي فإن : ∆ ط د = صفر إذا : كح2 – كح1 – شغ = صفر شغ = كح2 – كح1   مثال توضيحي على الآلة الحرارية ( الآلة البخارية ) : 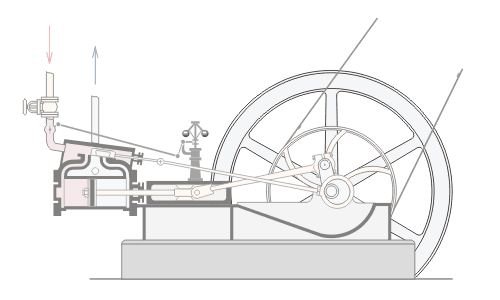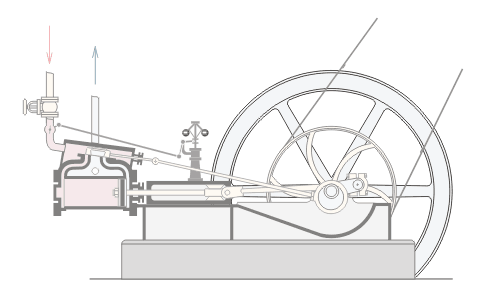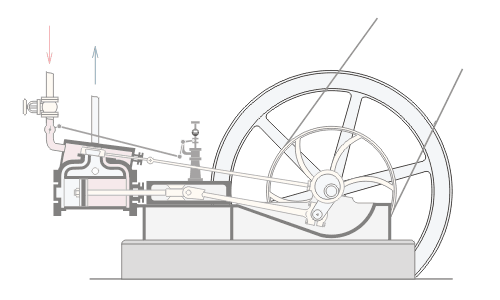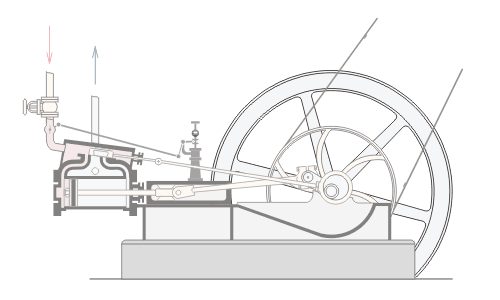 [FLASH="http://www.phys4arab.net/vb/images/sharh/de24.swf"]width=550 height=280[/FLASH] لحفظ الفلاش ، أضغط هنا بزر الفأرة الأيمن ثم أختر حفظ بإسم 1 – يمتص الماء الموجود في الغلاية الحرارة من المستودع الساخن فيتحول إلى بخار ( المستودع الساخن هنا عبارة عن وقود يتم حرقه لغلي الماء في الغلاية ) 2 – يُفتح صمام الدخول ويغلق صمام الخروج ، فيدخل البخار ليقوم بدفع المكبس إلى الخارج باذلا شغل ، وبذلك تنخفض درجة الحرارة البخار . 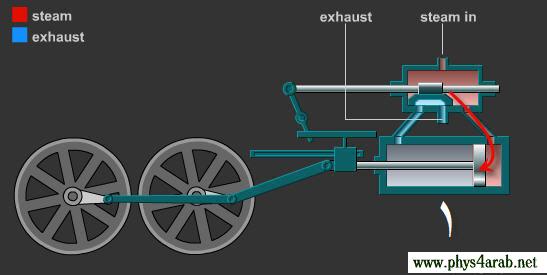 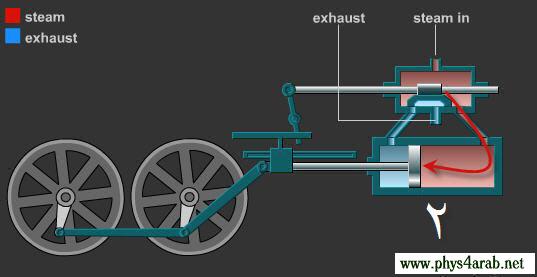 3 – عندما يصل المكبس إلى حده الأقصى ليبدأ في الرجوع ، يُغلق صمام الدخول ويفتح صمام الخروج فيخرج البخار في درجة حرارة منخفضة ، ثم يصل إلى المكثف ، الذي يكثف هذا البخار ليتحول إلى ماء ، ونتيجة لذلك يفقد جزءا من طاقته الداخلية ، فتطرد الحرارة الناتجة عن ذلك ( الحرارة الكامنة للتكثيف ) إلى الهواء الخارجي الذي يعتبر بمثابة المستودع البارد . 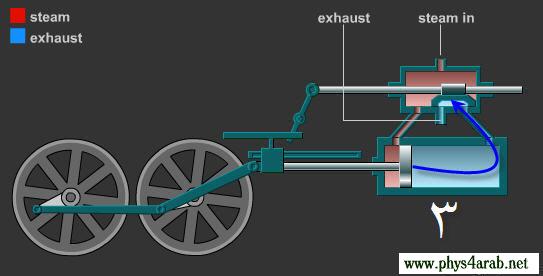 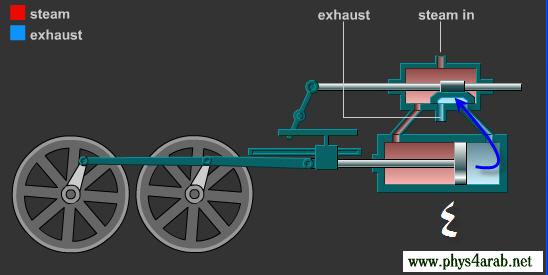 4 – تقوم المضخة بضخ الماء إلى الغلاية حيث تعاد الدورة من جديد . مثال توضيحي آخر على الآلة الحرارية ( السيارة ) : 1 – تأخذ طاقة حرارية من البنزين 2 – تحول الحرارة إلى شغل ميكانيكي ( حركة السيارة ) 3 – باقي الحرارة يخرج على شكل عادم من السيارة . مردود الآلة الحرارية ( كفاءتها ) : يعتبر المردود ( الكفاءة ) من أهم مميزات الآلة من الناحية العلمية . وتعرف كفاءة الآلة الحرارية على أنها النسبة بين ما تبذله الآلة من شغل إلى الطاقة الحرارية الكلية التي تأخذها من المستودع الساخن خلال دورة كاملة . أي أن : كفاءة الآلة = الطاقة المنتجة / الطاقة المعطاة = شغ / كح2 لكن شغ = كح2 – كح1 إذا : كفاءة الآلة = (كح2- كح1)/ كح2 كفاءة الآلة = 1 – ( كح1 / كح2 ) وقد وجد كارنو أن : (كح1/كح2 ) = ك1 /ك2 إذا : كفاءة الآلة = 1- ك1 /ك2 القانون الثاني للديناميكا الحرارية : تمهيد : القانون الثاني للديناميكا الحرارية جاء مكملا للأول حيث إن القانون الأول هو قانون لحفظ الطاقة فيخبرنا بأن أي زيادة في شكل من أشكال الطاقة يصاحبه نقص في الشكل الآخر ، كما أنه لا يميز الشغل من الحرارة ، إذ يمكن زيادة الطاقة الداخلية للنظام بتزويده بالحرارة أو ببذل شغل عليه ، وبمعنى آخر هناك تحولات محددة للطاقة يسمح بها القانون الأول ، فمثلا يمكن تحويل الشغل كليا إلى حرارة ، ولكن العكس في الواقع غير ممكن أي لا يمكن تحويل الحرارة كليا إلى شغل دون إحداث أي تغيير في الوسط المحيط . القانون الذي يبحث في أي العمليات ممكنة الحدوث وأيها مستحيلة هو القانون الثاني و له عدة صيغ ، وهي : 1 - صيغة ( كلفن – بلانك ) " من المستحيل بناء آلة حرارية تعمل بحيث تمتص طاقة حرارية من مستودع حراري واحد وتحولها كليا إلى شغل ميكانيكي " أي أنه لكي تنتج الآلة الحرارية شغلا يجب أن يكون لها مستودعان حراريان مختلفان في درجة الحرارة .  2 – صيغة ( كلاوزيوس الأولى ) " من المستحيل بناء آلة حرارية تعمل بحيث تمتص الحرارة من مستودع حراري ذي حرارة منخفضة ، وتطردها إلى مستودع آخر ذي درجة حرارة أعلى دون الحاجة إلى بذل شغل ميكانيكي "  |
|
#7
|
|||
|
|||
|
رد: الدُرر البهيّة في شرح الديناميكا الحراريّة - مع مناقشة شاملة للفصل الثالث ( 3ث -
جزاكم الله كل خير على الجهود المبذولة شرح وافي وواضح
|
|
#8
|
|||
|
|||
|
4- العملية الكظمية Adiabatic process :
هي العمليات التي تتم في النظام المعزول حراريا عن الوسط المحيط به ، حيث يكون الغاز محصورا في أسطوانة معزولة حراريا ، ومزودة بمكبس حر الحركة . 4 - إيجاد الشغل بيانيا في العملية الكظمية : بما أنه لا يوجد تبادل في الحرارة بين الغاز والوسط المحيط به حيث تتم هذه لعملية بسرعة كبيرة نسبيا ، فيكون الشغل مساويا للتغير في الطاقة الداخلية . [/COLOR][/SIZE][/RIGHT][/QUOTE] استاذي الفاضل ناصر كل عام انت بالف خير ونعمة وفضل حقيقة اني مسرور من هذه الدرر واحب ان اشارك معك في بعض الاراء لا على سبيل تصيد الاخطاء واني حقيقة اقدر لك هذا الجهد الذي اذهلني بصراحة فلك من الله خير الجزاء في الجزء الاول تعريف العملية قد يتبادر الى ذهن القارئ ان اي مكبس تجعل حولة مادة سيكون كظمي وهذا غير صحيح حسب علمي والله اعلم حيث ان هناك هدر للطاقة مهما كانت المادة العازلة في الحقيقة العملية وفي الواقع ولا يوجد اجراء او تغير كظمي 100% في الواقع ولكن اللاجراء الكمظمي الفعلي الذي يحدث هو التغير القصير المفاجئ الذي يحدث عند ضغط المكبس بسرعة حيث يكون خلال وقت قصير جدا اجراء كظمي ثم بعدها نسميه ايزو ثيرمي لان جزء من الطاقة اهدر على شكل حرارة حتى ولو كان بسيطا في الجزء الثاني هو تفسير الكلام الاول ولكن عند الحدوث السريع المفاجئ يسمى الاجراء كظمي حتى لو لم يكن معزول اي عند تعير الطاقة الداخلية تبعا لتغير الشغل قبل خروج الحرارة من النظام قد يكون فهمي قاصرا فان كان كذلك فمنكم نستفيد اسال الله لكم دوام العافية |
|
#9
|
|||
|
|||
|
السلام عليكم :
أخواني الفيزيائين الكرام : من خبرتي السابقة أن مساحة الأشكال غير المنتظمة تحسب بطريقة التكامل الرياضية ! فهل فك التكامل يحول العملية إلى لوغاريتم ؟ وإلاّ ماهو سر ظهور اللوغاريتم في حساب المساحة ؟؟ أرجو الإجابة . |
|
#10
|
|||
|
|||
|
لو سمحت يا أستاذنا الكريم ..... أنا سنه ثالث ثانوي .. وبصراحه ودي اسأل عن الهواء في الرئتين هل هو : نظام مفتوح - نظام مغلق- نظام معزول - نظام خارجي مع التوضيح لو سمحت ... لأن هذا السؤال جاني اليوم في اختبار الفيزياء وبعد الاختبار قعدت في جدااال أنا والمعلمه... فأرجووو الإجابه على هذا السؤال ... |
«
الموضوع السابق
|
الموضوع التالي
»
| الذين يشاهدون محتوى الموضوع الآن : 1 ( الأعضاء 0 والزوار 1) | |
| انواع عرض الموضوع |
 الانتقال إلى العرض العادي الانتقال إلى العرض العادي |
 العرض المتطور العرض المتطور |
 الانتقال إلى العرض الشجري الانتقال إلى العرض الشجري |
|
|
 المواضيع المتشابهه للموضوع: الدُرر البهيّة في شرح الديناميكا الحراريّة - مع مناقشة شاملة للفصل الثالث ( 3ث - ف1 )
المواضيع المتشابهه للموضوع: الدُرر البهيّة في شرح الديناميكا الحراريّة - مع مناقشة شاملة للفصل الثالث ( 3ث - ف1 )
|
||||
| الموضوع | كاتب الموضوع | المنتدى | مشاركات | آخر مشاركة |
| ملخص كتاب الطالب للفصل الثاني لمادة الفيزياء للصف الثالث | toofisa | الصف الثالث الثانوي | 50 | 08-01-2013 05:33 |
| قوانين شاملة للفصل الدراسي الثاني للصف الثالث | toofisa | الصف الثالث الثانوي | 26 | 20-05-2010 16:30 |
| ممكن ملخص عن الفصل الثالث : الديناميكا الحرارية | الساقي | الصف الثالث الثانوي | 7 | 08-11-2007 16:30 |
| ارجوا تلخيص للفصل الاول والثاني للفصل الدراسي الاول للامتحان الدوري | nody | الصف الأول الثانوي | 0 | 31-10-2006 13:44 |
المواضيع والمشاركات المنشورة لا تعبر عن رأي ملتقى الفيزيائيين العرب ولانتحمل أي مسؤولية قانونية حيال ذلك ويتحمل كاتبها مسؤولية النشر"
الساعة الآن 00:26




